-
Télécharger cette vidéo
-
Effectuer le travail présent dans ce document
Corrigé
Le corrigé se trouve à cette adresse
Télécharger cette vidéo
Effectuer le travail présent dans ce document
Le corrigé se trouve à cette adresse
L’objectif de cette séance est de titrer l’aspirine contenue dans un comprimé d’Aspirine du Rhône et d’ainsi vérifier que la masse présente est bien égale à 500 mg.
L’acide acétylsalicylique, plus connu sous le nom commercial d’aspirine, est la substance active de nombreux médicaments aux propriétés antalgiques (réduction de la douleur), antipyrétiques (réduction de la fièvre) et anti-inflammatoires (réduction de l’inflammation). Il est aussi utilisé comme antiagrégant plaquettaire. Il s’agit d’un anti-inflammatoire non stéroïdien. C’est un acide faible, dont la base conjuguée est l’anion acétylsalicylate. C’est un des médicaments les plus consommés au monde.
[Lire]L’objectif premier de cette séance est la détermination de la constante d’acidité du couple acide/base de l’acide méthanoïque. La méthode utilisée s’appuie sur une mesure de conductivité.
L’acide méthanoïque (appelé aussi acide formique) est le plus simple des acides carboxyliques. Sa formule chimique est $\ce{CH2O2}$ ou $\ce{HCOOH}$. Sa base conjuguée est l’ion méthanoate (formiate) de formule $\ce{HCOO-}$. Il s’agit d’un acide faible son $pK_a$ étant égal à 3,751 à $\pu{25 °C}$, qui se présente sous forme d’un liquide incolore à l’odeur pénétrante.
[Lire]L’objectif premier de cette séance est la détermination de la constante d’acidité du couple acide/base de l’acide acétique (éthanoïque). La méthode utilisée s’appuie sur des mesures de pH.
L’acide éthanoïque est naturellement présent dans le vinaigre. Il lui donne son goût acide et son odeur piquante. C’est un antiseptique et un désinfectant. L’acide acétique pur est un liquide très faiblement conducteur et incolore. Il doit être manipulé avec soin en suivant les consignes de sécurité. Son acidité est due à sa capacité à perdre le proton de son groupe carboxyle, le transformant ainsi en ion acétate $\ce{CH_3COO^-}$. C’est un acide faible, son $pK_a$ étant égal à 4,76 à $\pu{25 °C}$.
[Lire]Une particule $\alpha$ (noyau d’hélium : $\ce{^{4}_{2}He}$) arrive au point $O$ dans un condensateur plan avec une vitesse $\vec{v_0}$ de direction parallèle aux armatures $C$ et $D$ du condensateur.
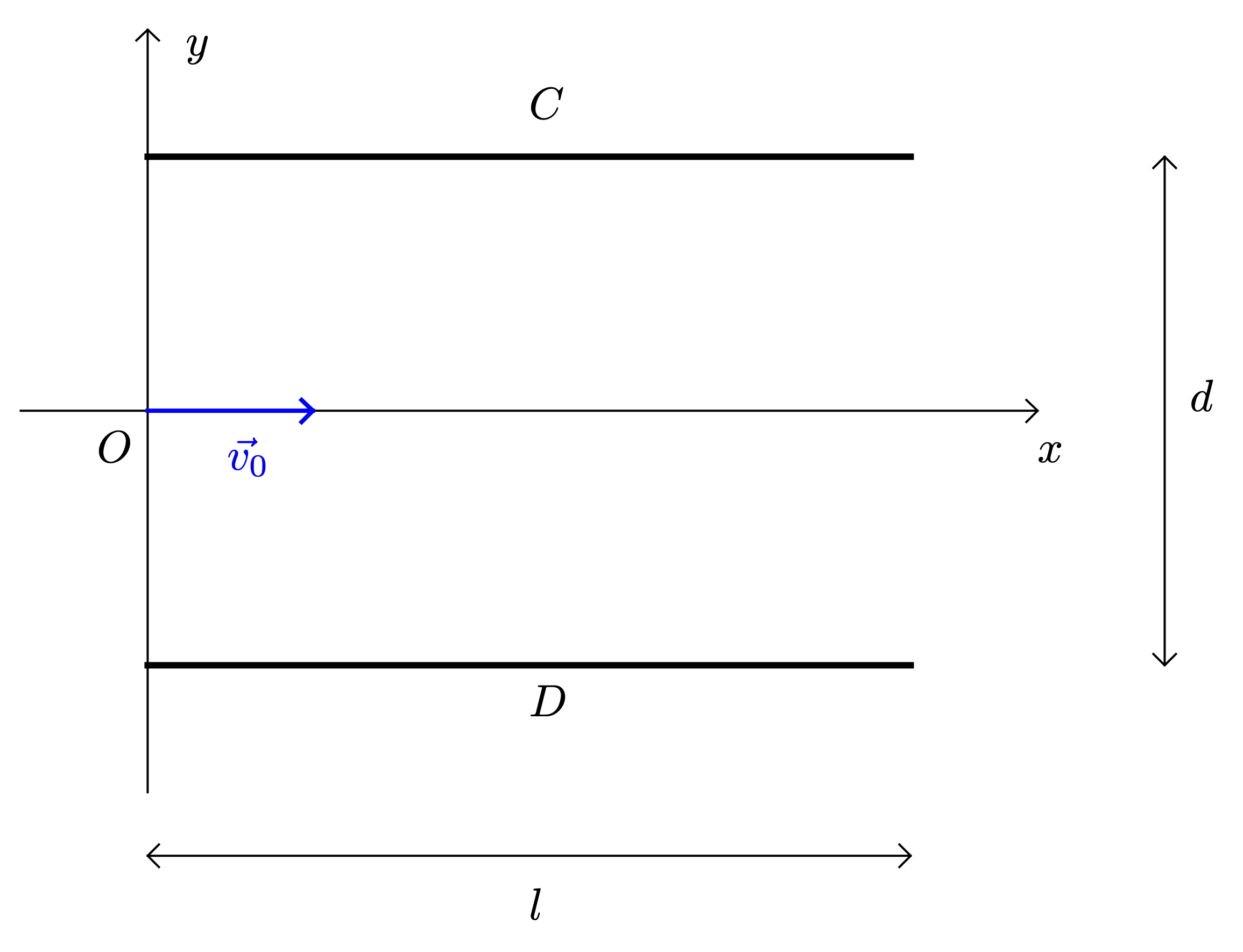
Une tension constante $U$ est appliquée entre ces deux armatures longues de $l = \pu{5,00 cm}$ et distantes de $d = \pu{4,00 cm}$.
Le problème posé par la nature des « rayons cathodiques » à la fin du XIXème siècle fut résolu en 1897 par l’Anglais J.J. Thomson : il s’agissait de particules chargées négativement baptisées par la suite « électrons ». La découverte de l’électron valut à Thomson le prix Nobel de physique en 1906. Le défi pour les scientifiques de l’époque fut alors de déterminer les caractéristiques de cette particule : sa charge électrique et sa masse. Dans un premier temps, Thomson lui-même, en étudiant la déviation d’un faisceau d’électrons dans un champ électrique, put obtenir le « rapport $e/m_e$ » de ces deux caractéristiques. C’est cependant l’Américain R. Millikan qui, réalisant de multiples expériences entre 1906 et 1913 sur des gouttelettes d’huile, détermina la valeur de la charge de l’électron.
[Lire]L’objectif de cette séance est de déterminer la concentration en acide éthanoïque d’un vinaigre à 5°.
Un vinaigre est une solution aqueuse diluée essentiellement constituée d’acide éthanoïque dont le $\text{pKa}$ est de 4,8. Le degré d’acidité d’un vinaigre est la masse d’acide éthanoïque pur contenue dans $\pu{100 g}$ de vinaigre.
Lors d’un suivi pH-métrique on mesure le pH de la solution après différents ajouts de titrant. Les volumes de titrant à verser doivent être évalués après un titrage colorimétrique et resserrés le plus possible autour de l’équivalence. Après le saut de pH, il faut poursuivre l’ajout de titrant pendant au moins $\pu{5 mL}$.
[Lire]La carence en élément calcium, ou hypocalcémie, peut être traitée par injection intraveineuse d’une solution de chlorure de calcium. On souhaite déterminer la concentration $C_o$ en chlorure de calcium contenue dans une ampoule de $\pu{10,0 mL}$. Le contenu de l’ampoule est dilué 100 fois. La mesure de la conductivité de la solution $S$ obtenue est os : $\sigma_S = \pu{1,23 mS.cm-1}$. On mesure également la conductivité de différentes solutions étalon en chlorure de calcium. Les résultats sont rassemblés dans le tableau ci-dessous :
[Lire]
La liqueur de Dakin (eau de Dakin) est une solution antiseptique utilisée pour le lavage des plaies et des muqueuses, de couleur rose et à l’odeur d’eau de Javel. Elle a pour avantage de ne pas être colorante (contrairement à l’éosine, par exemple) et de ne pas produire de sensation d’irritation à l’usage (contrairement à la Bétadine par exemple).
Lors de la Première Guerre mondiale, le chimiste d’origine britannique, installé aux États-Unis, Henry Drysdale Dakin met au point avec le chirurgien français Alexis Carrel un antiseptique (dont la substance active est l’eau de Javel) pour les plaies ouvertes ou infectées, dans le cadre des travaux de ce dernier sur le traitement des plaies de guerre.
[Lire]