Courant électrique
On appelle courant électrique le déplacement d’ensemble de charges électriques.
- Dans les solides, les charges mobiles sont les électrons ;
- Dans les solutions ionique, les charges mobiles sont les ions.
- À l’extérieur d’un générateur, le courant électrique circule du point de plus haut potentiel électrique (borne $+$ du générateur) vers le point de plus bas potentiel électrique (borne $-$ du générateur).
- Cette circulation correspond à la circulation des charges positives.
- Dans un circuit solide, aucune charge positive ne peut se déplacer. Les électrons circulent donc dans le sens opposé au sens de circulation du courant électrique.
- Toute solution ionique est électriquement neutre : elle contient donc forcément des cations et des anions. Les cations circulent dans le même sens que le courant électrique alors que les anions circulent dans le sens opposé au sens de circulation du courant électrique.
Conductance d’une solution ionique
Résistance et conductance
Rappel
Lorsqu’on mesure la tension électrique $U$ aux bornes d’un conducteur ohmique et l’intensité $I$ du courant électrique le traversant, on constante que ces deux grandeurs sont proportionnelles : $U = R\cdot I$. $R$ le coefficient de proportionnalité est appelé la résistance électrique du conducteur ohmique. On peut aussi écrire cette relation sous la forme $I = G \cdot U$ où $G = 1/R$ est la conductance du conducteur ohmique (unité : $\pu{S}$, siemens).
En chimie
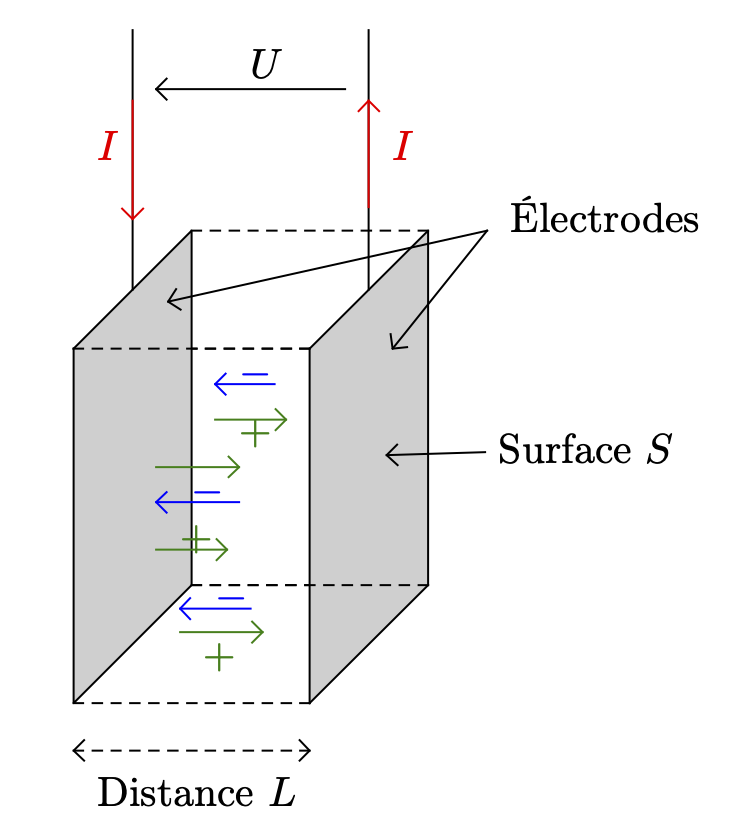
Deux plaques conductrices reliées à un générateur basse fréquence (courant alternatif) et plongées dans une solution aqueuse diluée ont un comportement électrique que l’on peut modéliser comme étant celui d’un conducteur ohmique : une solution ionique possède une résistance (ou une conductance)1.
Influence de différents paramètres expérimentaux sur la conductance d’une solution ionique
Résultats expérimentaux
- La conductance $G$ d’une portion de solution ionique, de section $S$ et de longueur $L$, diminue quand $S$ diminue ou quand $L$ augmente.
- La conductance d’une solution ionique augmente quand la concentration molaire en soluté chargé apporté croît.
- La conductance d’une solution ionique augmente quand la température croît.
- La conductance d’une solution ionique dépend de la nature des ions présents.
Bilan
Les paramètres modifiés pour parvenir aux différents résultats2, dans la section précédente, peuvent être classés en deux catégories :
- ceux qui dépendent de la nature de la solution chimique ;
- ceux qui ne dépendent que de la construction de la cellule.
La conductance $G$ d’une portion de solution ionique, de section $S$ et de longueur $L$, peut se mettre sous la forme : $$G = \sigma \cdot \dfrac{S}{L}$$
Unités : $G$ en siemens $\pu{S}$, $\sigma$ en siemens par mètre $\pu{S.m-1}$, $S$ en mètre carré $\pu{m2}$, $L$ en mètre $\pu{m}$.
- Le quotient $\dfrac{S}{L}$ est une caractéristique de la cellule utilisée. Il est généralement déterminé à la construction de la cellule.
- La grandeur $\sigma$ est appelée conductivité de la solution, elle dépend de la nature et de la concentration des ions présents dans la solution et de la température.
Conductivité d’une solution ionique – Loi de Kohlrausch
Unité : $\pu{S.m2.mol-1}$.
Conductivité molaire ionique
Unité : $\pu{S.m2.mol-1}$.
Remarque : La conductivité molaire ionique d’un ion ne dépend que de la température et de la nature de l’ion.