Transformations forcées
Changer le sens d’évolution d’une transformation
Manipulation
-
Sous la hotte, on introduit dans un tube à essai, $\pu{4 mL}$ d’une solution aqueuse $S$ de dibrome $\ce{Br2 (aq)}$ à $\pu{0,01 mol.L-1}$ et quelques tournures de cuivre métallique $\ce{Cu (s)}$. On laisse le système évoluer pendant quelques minutes et on observe.
- La coloration de la solution change : initialement jaune, elle devient vert.
-
Dans deux tubes à essai $A$ et $B$ contenant $\pu{0,5 mL}$ de cyclohexane, on introduit, dans le tube $A$, $\pu{1 mL}$ de $S$ et, dans le tube $B$, $\pu{1 mL}$ du mélange après réaction. On bouche, on agite et on observe.
- Le mélange eau-cyclohexane est hétérogène. Le cyclohexane constitue la phase supérieure.
- Dans le tube à essai $A$, la phase aqueuse se décolore alors que la phase organique se colore en orange/marron.
- Dans le tube à essai $B$, la phase aqueuse se colore en bleu alors que la phase organique se colore en orange/marron. La coloration de cette phase est moins marquée que celle dans le tube $A$.
- Le dibrome appartient au couple $\ce{Br2/Br-}$, le couple appartient au couple $\ce{Cu^{2+}/Cu}$. Écrire l’équation de la réaction qui se déroule dans le bécher.
Réponse
$$ \ce{Br2 (aq) + Cu (s) <=> 2 Br- (aq) + Cu^{2+} (aq)} $$
- La constante d’équilibre associée à la réaction précédente vaut $K = \pu{1,2e25}$.
Prédire le sens d’évolution spontanée du système.
Réponse
-
$Q_{r,i} = \dfrac{[\ce{Br-}]_i^2 \cdot [\ce{Cu^{2+}}]_i}{[\ce{Br2}]_i \cdot C^{o2}} = 0$.
-
$Q_{r,i} < K$, le système évolue dans le sens direct d’écriture de l’équation de la réaction chimique.
- Ce résultat est-il en accord avec les observations ?
Réponse
- Observation 1 : la coloration de la solution varie, il existe une réaction chimique.
Remarque : Le cyclohexane et l’eau ne sont pas miscibles, la densité du cyclohexane est inférieure à celle de l’eau.
-
Observation 2 : Le dibrome est plus soluble dans le cyclohexane que dans l’eau. Il colore un peu différemment les deux milieux.
-
Observation 3 : La coloration de la phase organique laisse penser qu’il reste du dibrome à la fin de l’expérience (reste car la coloration est moins marquée que celle du tube $A$, ce qui laisse entendre qu’une partie du dibrome a disparu). La coloration de la phase aqueuse laisse penser que des ions cuivre sont apparus dans le milieu.
Ces observations valident donc la réaction spontanée entre le dibrome et le cuivre.
- Que peut laisser penser la valeur de la constante d’équilibre sur le taux d’avancement final de la transformation ?
Réponse
La valeur très élevée de la constante d’équilibre laisse penser que la transformation chimique est pratiquement totale, le taux d’avancement final de la transformation doit donc être proche de 1.
Dans un tube à essai, on introduit $\pu{2 mL}$ d’une solution de bromure de potassium, $\ce{K+ (aq) + Br-(aq)}$, à $\pu{1 mol.L-1}$ et $\pu{2 mL}$ d’une solution de sulfate de cuivre (II), $\ce{Cu^{2+} (aq) + SO4^{2-} (aq)}$ à $\pu{1 mol.L-1}$.
- Aucune modification du milieu laisse penser que le système évolue.
- Écrire l’équation de la seule réaction chimique susceptible de se produire dans le milieu.
Réponse
$$ \ce{2 Br- (aq) + Cu^{2+} (aq) <=> Br2 (aq) + Cu (s)} $$
- Déterminer la valeur de la constante d’équilibre de la réaction précédente.
Réponse
$K’ = \dfrac{1}{K} = \pu{8,3e-26}$.
- Peut-on expliquer l’absence apparente d’évolution ?
Réponse
-
$Q_{r,i} = \dfrac{[\ce{Br2}]_i \cdot C^{o2}}{[\ce{Br-}]_i^2 \cdot [\ce{Cu^{2+}}]_i} = 0$.
-
$Q_{r,i} < K’$, le système évolue spontanément dans le sens direct de l’équation de la réaction, qui correspond à la formation de cuivre et de dibrome. Cependant, la valeur très petite de la constante d’équilibre permet de prévoir que le système chimique avance très peu : on peut considérer que le système n’évolue quasiment pas.
Aucune évolution n’est effectivement observée
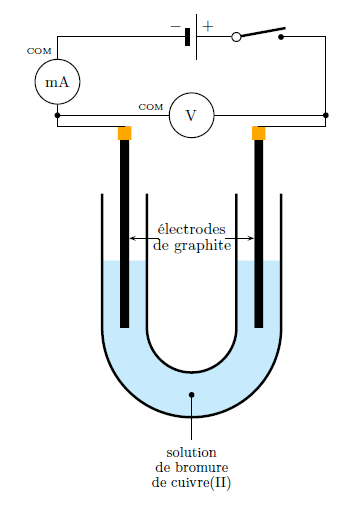 > Avant...
> Avant...
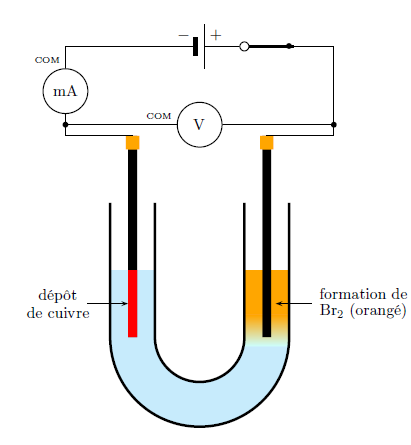 > Après...
> Après...
- Quel est le sens du courant électrique dans le circuit ? Préciser le sens de déplacement des différents porteurs de charges mis en jeu.
Réponse
- Le générateur impose le sens du courant électrique : ce dernier quitte la borne positive du générateur et circule jusqu’à la borne négative.
- Le sens de circulation du courant électrique est le sens de circulation des charges positives. Les charges positives (cations dans la solution) circulent donc de la borne positive vers la borne négative du générateur.
- Les charges négatives (électrons dans les fils du circuit et anions dans la solution) circulent dans le sens opposé au sens de circulation du courant électrique. Elles se déplacent donc de la borne négative à la borne positive du générateur.
- Proposer une interprétation des phénomènes observés aux électrodes.
Réponse
-
Électrode connectée à la borne positive du générateur: les électrons quittent cette électrode, il sont donc libérés par une réaction d’oxydation. Le seul réducteur est $\ce{Br- (aq)}$ : $$ \ce{2 Br- (aq) -> Br2 (aq) + 2 e-} $$
-
Électrode connectée à la borne négative du générateur : les électrons parviennent à cette électrode, ils sont donc consommés par une réaction de réduction. Le seul oxydant est $\ce{Cu^{2+} (aq)}$ : $$ \ce{Cu^{2+} (aq) + 2 e- -> Cu (s)} $$
- Comparer l’évolution de ce système avec celle étudié lors des expériences précédentes. Existe-t-il une contradiction entre ces évolutions ?
Réponse
Dans cette dernière expérience, le système évolue dans le sens inverse du sens spontané mis en évidence lors des expériences précédentes. Ce résultat n’est pas en contradiction avec les conclusions précédentes puisqu’ici il n’est pas question d’une transformation spontanée mais d’une transformation forcée par le passage du courant électrique généré par le générateur.
Électrolyse
-
Une électrolyse est une transformation forcée due à la circulation d’un courant électrique imposé par un générateur.
Le générateur fournit l’énergie électrique nécessaire pour imposer au système d’évoluer dans le sens inverse de son sens d’évolution spontanée, et donc de s’éloigner de son état d’équilibre. -
Connaissant le sens du courant, on peut envisager les différentes oxydations possibles à l’anode et les différentes réductions possibles à la cathode en sachant que le solvant et les électrodes peuvent participer à ces réactions.
C’est l’analyse des produits formés qui permet de déterminer les réactions qui se produisent effectivement aux électrodes. -
Lors d’une transformation forcée, le quotient de réaction $Q_r$ s’éloigne toujours de la constante d’équilibre $K$.
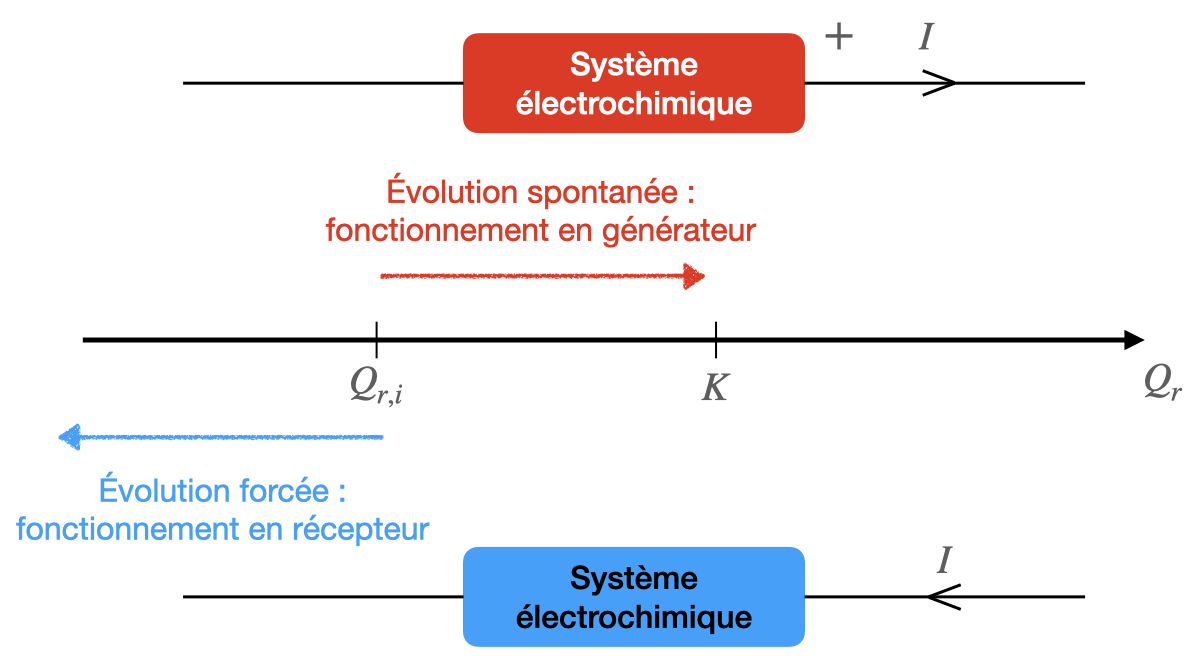
Bilan de matière d’une électrolyse
-
On réalise l’électrolyse d’une solution d’acide sulfurique $(\ce{2 H+ (aq) + SO4^{2-} (aq)})$ :
-
à la cathode, la réaction a pour équation : $\ce{2 H+ (aq) + 2 e- -> H2 (g)}$ ;
-
à l’anode, la réaction a pour équation : $\ce{2 H2O (l) -> O2 (g) + 4 H^+ (aq) + 4 e-}$
-
le bilan est donc : $$ \ce{2 H2O (l) -> O2 (g) + 2 H2 (g)} $$
Expérimentalement, on doit constater que le volume de dihydrogène formé est le double de celui du dioxygène.
-
-
Au cours d’une électrolyse, réalisée pendant une durée $\Delta t$ en maintenant l’intensité $I$ du courant électrique constante, la quantité d’électricité $Q$ qui traverse une section du circuit électrique est : $$ Q = I\, \Delta t $$ avec $Q$ en coulomb (C), $I$ en ampère (A) et $\Delta t$ exprimé en seconde (s).
Cette quantité d’électricité est liée à la quantité d’électrons transférés $n (e^-)_{\text{transf}}$ d’une électrode à l’autre suivant : $$Q = n (e^-)_{\text{transf}}\, \mathcal{F}$$ avec $n (e^-)_{\text{transf}}$ exprimé en mole (mol), $\mathcal{F}$, constante de Faraday, exprimée en coulomb par mole ($\pu{C.mol-1}$). -
Si, par exemple, on s’intéresse à la quantité de matière de dioxygène formé au cours de l’expérience :
État Avancement (en mol) $\ce{2 H2O (l)}$ $\ce{–>}$ $\ce{O2 (g)}$ $+$ $\ce{4 H+ (aq)}$ $+$ $\ce{4 e-}$ Initial $x = 0$ excès 0 excès 0 Final $x = x_f$ excès $x_f$ excès $4\, x_f$ La quantité de matière d’électrons transférés lors de l’électrolyse est telle que : $$ n (e^-)_{\text{transf}} = 4\, x_f = \dfrac{I\, \Delta t}{\mathcal{F}} \qquad \text{donc} \qquad x_f = \dfrac{I\, \Delta t}{4\, \mathcal{F}} $$ Finalement : $$ n (\ce{O2})_f = x_f = \dfrac{I\, \Delta t}{4\,\mathcal{F}} $$
La transformation forcée du système chimique cesse :
-
lorsque l’un des réactifs (au moins) a été totalement consommé ;
-
parce que l’électrolyse a été volontairement interrompue (ouverture du circuit).
Exemples d’applications
Les accumulateurs
- Grâce à l’électrolyse, il est en théorie possible de reformer les réactifs consommés dans une pile usée. Cependant, des réactions « parasites » peuvent être déclenchées en parallèle et former des produits gazeux susceptibles de détruire la pile.
- Il existe des systèmes électrochimiques rechargeables dans lesquels il est possible de reformer les réactifs par électrolyse : les accumulateurs.
Applications industrielles
Les dépôts métalliques
L’électrolyse est utilisée pour déposer certains métaux (or, argent, cuivre, zinc, ...) sur un objet conducteur d’électricité dans le but de le protéger de la corrosion ou de l’embellir.
L’objet à recouvrir est plongé dans une solution contenant des ions du métal devant être déposés à sa surface. Il est ensuite relié à la borne négative d’un générateur afin de constituer la cathode lors de l’électrolyse.
- Exemples
-
-
L’électrozingage d’un objet en fer plongeant dans une solution de chlorure de zinc (II), permet de déposer une couche protectrice de zinc à la surface de l’objet afin d’éviter la corrosion du fer.
-
L’argenture des couverts de table est réalisée en réduisant des ions argent (I) à la surface des couverts constituant la cathode lors de l’électrolyse d’une solution contenant des ions argent (I).
-
Le cuivrage des pièces de un à cinq centimes d’euro se fait par électrolyse d’une solution de nitrate de cuivre (II) dans laquelle plongent les pièces reliées à la borne négative du générateur.
-
La production d’eau de Javel
L’eau de Javel est obtenue industriellement par électrolyse d’une solution aqueuse de chlorure de sodium. Il se produit les réactions suivantes aux électrodes :
-
à la cathode : $\ce{2 H2O (l) + 2 e- –> H2 (g) + 2 HO- (aq) }$
-
à l’anode : $\ce{ 2 Cl- (aq) –> Cl2 (g) + 2 e- }$
Bilan : $$ \ce{2 H2O (l) + 2 Cl- (aq) –> Cl2 (g) + H2 (g) + 2 HO- (aq) } $$
Le dichlore produit en milieu basique réagit avec les ions hydroxyde pour donner, entre autres, l’ion hypochlorite $\ce{ClO- (aq)}$ qui est l’agent actif de l’eau de Javel : $$ \ce{Cl2 (g) + 2 HO- (aq) –> ClO- (aq) + Cl- (aq) + H2O (l)} $$
La production d’oxydants
- Des oxydants puissants comme les ions permanganate ou le peroxyde d’hydrogène sont aussi obtenus par oxydation anodique.